摘要
严重急性呼吸系统综合征冠状病毒2 (SARS-CoV-2)引起的呼吸道疾病冠状病毒病2019 (COVID-19)迫切需要有效的治疗方法。药物开发过程是一个成本高昂、步调细致的过程,在这个过程中,最初有希望的线索的失败往往会阻碍进展。为了应对这一挑战,需要对体外人体微生理系统进行完善和调整,以用于机理研究和药物筛选,从而在大流行危机期间节省宝贵的时间和资源。SARS-CoV-2病毒攻击肺部,而肺部独特的三维结构对正常呼吸功能至关重要。体外肺模型本质上再现了不同的组织结构和不同细胞类型之间的动态机械和生物相互作用。目前的模型系统包括Transwell、类器官和器官芯片或微生理系统(MPSs)。我们回顾了与COVID-19病理建模直接相关的模型,包括炎症、水肿、凝血过程以及肺免疫功能。我们还考虑了可能影响MPS设计和制造的实际问题。在多器官模型的背景下探讨了肺MPS的作用,并讨论了如何将高通量筛查和人工智能与肺MPS相结合,以加快COVID-19和其他传染病的药物开发。
简介
在本综述发表之时,由严重急性呼吸系统综合征冠状病毒2 (SARS-CoV-2)引起的2019冠状病毒病(COVID-19),自2019年12月在中国武汉出现以来,已感染全球5400多万人[1].与COVID-19相关的并发症已导致100多万人死亡,许多幸存患者严重发病,并在世界各地造成经济破坏[2,3.,4,5,6,7,8].尽管协作和多学科研究工作加快了COVID-19药物的开发和重新定位[9,10,11,到目前为止还没有建立有效的治疗方法。鉴于迫切的需求和有限的资源,使用微生理系统(MPSs)或器官芯片系统筛选先导化合物,在测试新药物或重新定位的药物的安全性和有效性以及研究这些药物的作用机制方面,可以提供比传统方法更多的优势。COVID-19药物可分为抑制病毒进入(通过靶向SARS-CoV-2刺突蛋白及相关受体和介质)、阻断病毒复制、治疗感染相关炎症(维持可耐受的细胞因子水平)、预防感染组织的凝血和血栓形成、预防或逆转肺泡水淹以及预防纤维化。药物靶向病理过程的体外再现需要在细胞和组织水平上深入了解疾病状态。例如,COVID-19的死亡率往往是由于肺泡泛滥,这有三个主要原因:上皮屏障失败,阿米洛利敏感钠的抑制+肺泡上皮内的通道(从而破坏肺泡腔内液体的吸收),或失去表面活性物质的功能。通过对疾病状态的特定方面进行建模,MPS可以在加速、降低风险或补充对各种病理的新治疗的发展方面发挥关键作用。关于用于药物开发的一般器官芯片和肺芯片模型的优秀评论已经发表[12,13,14].在此,我们提供了体外肺MPS的最新进展,并讨论了MPS在COVID-19相关机制研究和药物筛选中的进一步发展。
肺功能建模
在过去的二十年中,肺组织细胞功能和相互作用的体外建模已经从一个相对简单的共培养环境发展到MPS来模拟肺中的生物力学、生物化学和生物因子,例如Transwell系统、类器官和MPS(图。1).
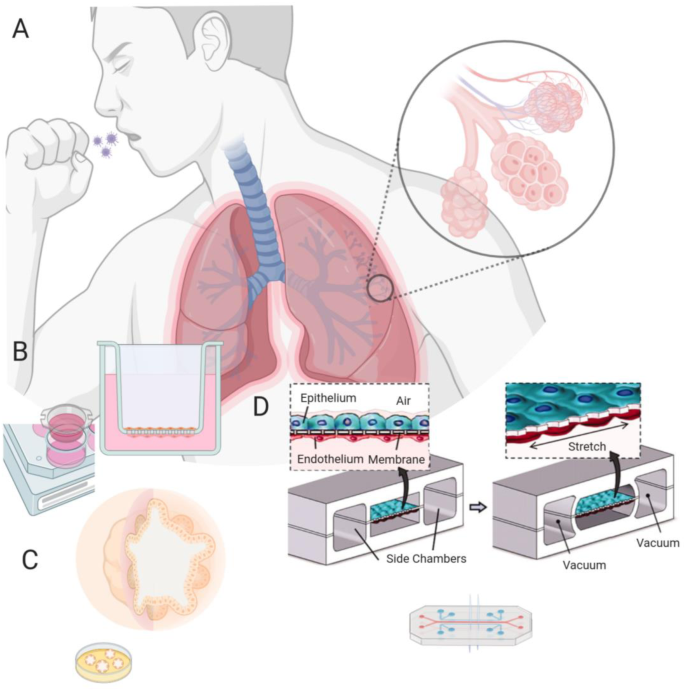
转载经Huh等人许可[19,版权2010年
COVID-19肺微生理系统。一个肺在结构上具有独特的组织结构,其特征是气道的连续精细分支系统终止于肺泡,肺泡中循环系统的血液发生氧化作用。为了开发抗COVID-19 (SARS-CoV-2病毒感染导致的疾病)病理损伤的药物,需要一个准确、快速部署的肺泡水平肺模型。b在研制真肺MPS之前,Transwell系统将一种贴有薄膜的插入到多孔细胞培养分析板中。插入防止液体通过的膜,形成气液界面,肺泡上皮细胞和血管内皮细胞可以在两侧生长。c类器官可以通过将干细胞植入细胞外基质形成,然后使用一系列生长因子将它们分化成一组肺细胞,这些肺细胞可以组织类似体内组织结构的空间复杂组织。d肺微生理系统或肺芯片;一种PDMS微器件,其表面有一层薄的PDMS涂层,外膜作为肺泡上皮-毛细血管边界。呼吸运动是通过对侧腔室施加真空来产生肺泡-毛细血管膜的机械拉伸来重新创造的。
Transwell系统
肺泡上皮细胞可在细胞外基质(ECM)包被或未包被的组织培养塑料上进行二维培养。这种2D培养系统可以通过放置Transwell插入物进行修改,将培养物提升到井底上方的半透膜上,从而在膜下形成一个介质库。系统中产生的新表面,如现在空的井底和插入膜的底部,可以用来培养其他类型的细胞,如内皮细胞(图1)。1b). Transwell系统还允许上皮细胞层在气液界面上生长,允许上皮细胞向分泌粘液的杯状细胞分化[15].一项使用右旋糖酐和荧光染料的概念证明研究表明,尽管与后面讨论的微流控MPS装置相比,Transwell系统中肺泡细胞占据膜的渗透性较低,但两种系统中70 kda右旋糖酐的屏障渗透性相似[16].以类似的方式,为了确定主要的跨上皮转运类型,跨壁电压(Vte)可以用电压感应荧光探针测量。小型荧光探针也可用于确定紧密连接的完整性。跨上皮电阻(TEER)是屏障功能和阿米洛利敏感的指标Vte(这是上皮细胞从肺泡腔内清除液体能力的指标),可以用装有专门固定宽度双电极的电压表测量。基底外侧和顶端介质可以采样释放化合物。在超微结构方面,生长在插入物上的细胞与生长在气-液界面系统中的细胞具有相似的分化[17].Transwell系统的优势在于其相对简单,可以在48个插入套内快速部署。Transwell培养的一个问题是,缺乏微流体流动不会对细胞产生生理剪切应力或压力,这可能导致与流体应力细胞相比,细胞间的通透性不同。
瀑样
类器官的广泛使用始于2009年,当时Hans Clevers和他的同事从干细胞中培育出一种自组织结构,这种结构分化成具有类器官特征的组织[18].类器官是将多能或诱导多能干细胞(PSC/iPSC)播撒到胶原蛋白或ECM溶液的悬浮簇上,如基质(从Engelbreth-Holm-Swarm (EHS)小鼠肉瘤细胞中分离出的ECM),并添加适当的生长因子使细胞分化成感兴趣的类器官谱系[19,20.].凝胶内形成中空的上皮细胞球,其顶端膜朝内(图)。1c).球体可以在原位研究或通过酶处理释放形成悬浮液。目前的跨上皮离子转运过程的类型和大小可以根据单个类器官体积的变化来确定。例如,环磷酸腺苷(cAMP)升高剂会导致鼻上皮类器官肿胀,但囊性纤维化患者除外[21].因此,肿胀可能是由于囊性纤维化跨膜电导调节器(CFTR)依赖性氯离子(Cl .)的激活所致- - - - - -)的分泌。同样,使用阿米洛利后肿胀表明存在活性钠离子(Na+)吸收,这个过程对抗肺泡泛滥。不幸的是,对阿米洛利敏感的钠+通道位于顶膜上,而229-Da阿米洛利分子足够小,足以让足够数量的阿米洛利分子在紧密连接上扩散。根据组织工程肺的分化特点,类器官分为气管球、支气管球和肺泡球。通过白细胞介素-6 (IL-6)/信号换能器和转录蛋白激活因子3 (STAT3)、骨形态发生蛋白(BMP)和成纤维细胞生长因子(FGF)的应用,可以维持具有I型和II型肺泡细胞的肺泡球[19].聚类规则穿插的短回文区域(CRISPR)/CRISPR相关蛋白9 (Cas9)方法已经在气道细胞中鉴定出一种调节转录因子,该转录因子可能有助于识别对类器官细胞分化和疾病形成重要的生长因子通路的敲入/敲出/敲除[22,23,24].类器官可以在各种微环境中培养,条件广泛;用聚丙交酯覆盖肺类器官有限公司-glycolide) (PLGA)允许它们在体内植入和成熟[25].类器官的缺点包括缺乏测试吸入疗法所必需的充满空气的腔体,缺乏可接近的内皮内衬腔体,以模拟肺循环界面药代动力学研究所必需的脉管系统,以及生长、分化和成熟的可变性[19,22,26].类器官的另一个问题是冠状病毒受体血管紧张素转换酶2 (ACE2,在第2节中讨论)。ACE2和病毒入侵),位于顶膜内。因此,需要温和的酶和物理破坏来将病毒和受体结合在一起[27].因此,不同研究之间的中断程序的差异可能导致结果的可变性。
肺microphysiological系统
器官芯片方法(与微生理系统互换使用的术语)使用微流控技术在器官型配置中培养细胞。这些微流控器件的制造方法借鉴了半导体工业,因此得名[28].Huh等人在2010年通过在聚二甲基硅氧烷(PDMS)中蚀刻两个相邻的通道,用10 μm的多孔柔性PDMS膜分离出肺泡器官芯片模型[29].将细胞外基质覆盖在膜两侧后,含肺上皮细胞或血管内皮细胞的溶液流入通道,使细胞在膜两侧定植和扩张(图1)。1d).一旦细胞汇合,从顶部通道取出生长介质,形成气液界面。PDMS的灵活性允许随着空气压力的变化进行循环拉伸,模拟在体内呼吸过程中发生的应力-应变模式[29,30.].这种拉伸影响渗透性和活性氧、细胞因子和表面活性剂的释放[29,30.,31].肺芯片系统的一个优点是,其他类型的细胞可以与上皮细胞分离生长,但要靠近上皮细胞,从而模拟体内的相互作用。此外,三通(29)和amiloride-sensitiveVte可以在这样的系统中测量。在不改变振荡压力的微流体条件下培养肺泡细胞模拟呼吸的比较显示TEER高于Transwell培养[32].Stucki等人使用电极同时监测TEER和上皮运动,从而实现了动态三维肺泡微环境的建模[33].对肺MPS的批评是,在COVID-19这样的威胁迅速扩大的情况下,单个芯片的设计很复杂,可能难以组装和使用足够数量的药物筛选。以基于mps的创业公司和分拆公司的形式,人们已经做出了努力来补救这种情况[34,图中显示了一个显著的例子。2,这是一个Akura基于InSphero AG平台,采用无泵浦微流体循环对类器官进行片上灌注[35].
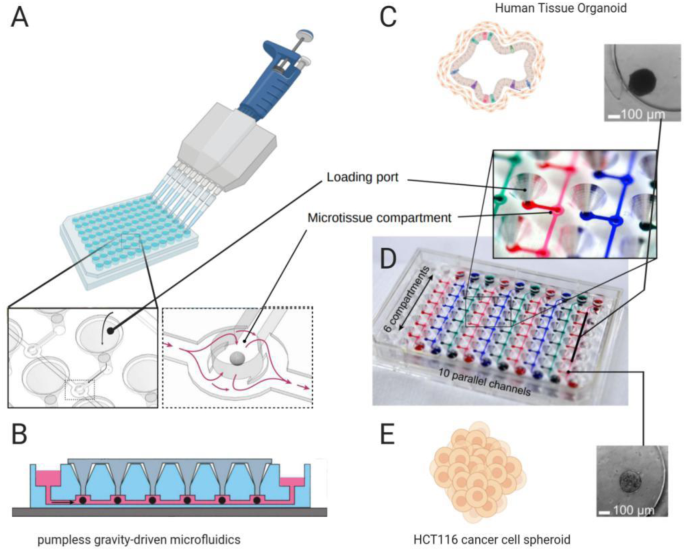
经Frey等人许可转载[35,版权2015年。b无泵流动由重力驱动,交替设置允许连续流动。c5倍镜下显示MPS中灌注了人体组织类器官(hLiMT)。d使用彩色染料显示堆叠多达60个实验。e1倍放大显示癌细胞(HCT116)球形
Pumpless瀑样议员。一个可以将类器官加载到MPS中,然后通过微流体灌注。
建模肺部病理
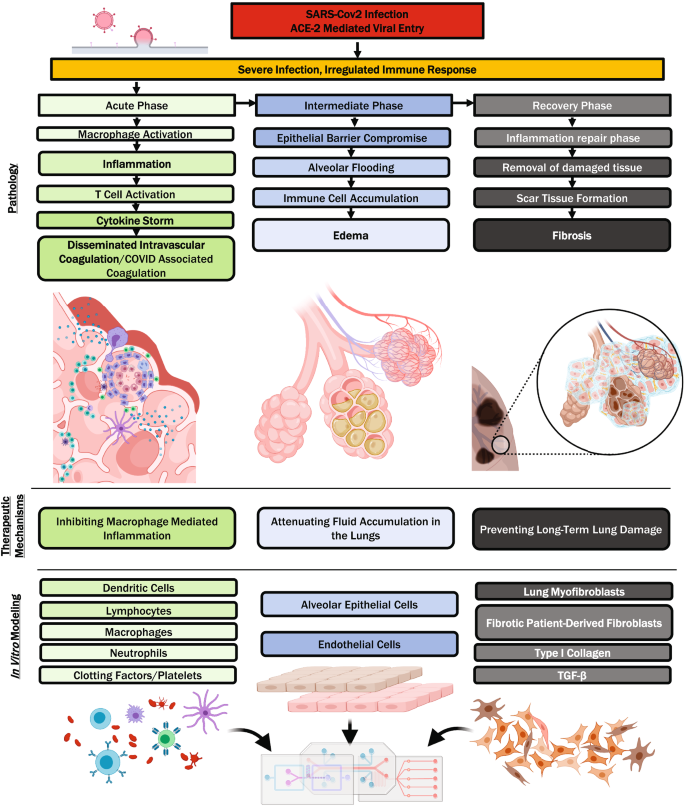
目前存在几种用于COVID-19药物发现的体外肺模型,每种模型都有其独特的优势;然而,肺mps是多功能的,并已证明在COVID-19的几种病理表现中有用。在接下来的章节中,我们将讨论mps是如何帮助新药候选药物测试的,以及它们可以进一步帮助的潜在方式。特别是COVID的病理可以分为以下几个阶段:SARS-CoV-2病毒通过ACE2受体进入;先天性免疫反应发炎或先天免疫反应失常;凝血功能障碍或凝血功能失调;水肿或肿胀和积液;纤维化或通过纤维化结缔组织形成的瘢痕(图。3.).
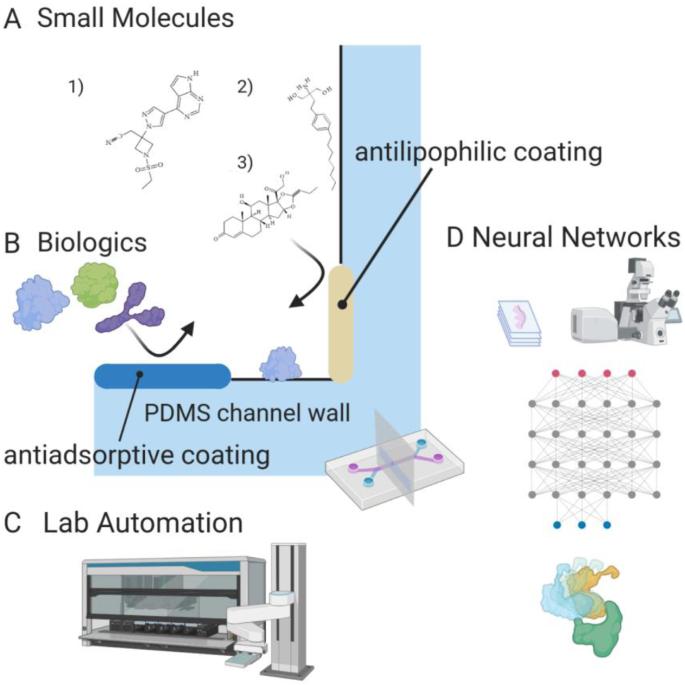
肺MPS的挑战和即将到来的进展。一个小的,典型的亲脂分子结合表面,如PDMS通道壁,可以用Langmuir-Freundlich等温线来表征。在PDMS表面涂上麻痹剂或使用溶胶-凝胶法可以防止亲脂性结合[156,157].a1Baricitinib是一种janus相关激酶(JAK/STAT)抑制剂免疫抑制剂,用于治疗covid相关的噬血细胞性淋巴组织细胞病(HLH) [76].a2Fingolimod,一种用于多发性硬化症的药物[89].脂族结构域如疏水尾部为药物结合通道壁创造了机会。a3布地奈德,一种抗炎类固醇,对肺MPS进行了比较试验[90].b生物制剂,如抗体和重组蛋白吸附到PDMS通道壁;防止吸附的方法有氧等离子体处理、两亲自组装单层和亲水聚合物接枝涂层[157,161].c将MPS设备与自动液体处理和连续流动相结合,将为简化药物发现工作流程和增加筛选先导化合物的吞吐量带来新的潜力。d机器学习和神经网络等人工智能算法可以通过分子对接和设计、图像分析和毒性预测来帮助药物发现。有效的使用包括生成和寻找足够大的数据集来训练算法,以做出准确的预测
ACE2和病毒入侵
ACE2酶是一种85.9 kda膜结合锌金属蛋白酶,通过将血管紧张素II转化为血管紧张素i来反调节肾素-血管紧张素-醛固酮轴。当病毒颗粒上的刺突蛋白与ACE2结合时,SARS-CoV-2和SARS-CoV病毒进入表达ACE2的细胞,当ACE2被回收时被内消化。然后,病毒离开核内体进入宿主细胞的细胞质,利用宿主细胞的蛋白质合成机制,利用其RNA基因组进行复制。以这一途径为靶点的药物在现有的COVID治疗中占很大一部分。SARS-CoV爆发后,9%发表的治疗学论文集中在ACE2。再加上突刺蛋白,这一总数接近三分之一[36].SARS-CoV-2对ACE2的亲和力是SARS-CoV的20倍,这证明了在药物开发中分析ACE2靶点的努力是正确的[37].计算筛选被证明是有效的结合细胞培养来筛选潜在的导联。在一个例子中,流感神经氨酸酶与冠状病毒蛋白酶3CLPro的结构相似性表明,神经氨酸酶抑制剂奥司他韦对SARS-CoV-2具有抗病毒作用。不幸的是,分子对接显示抑制作用很弱,这在表达ace2的Vero E6细胞培养中得到了证实[38].然而,计算对接对SARS-CoV-2刺突蛋白和蛋白酶显示了有希望的结果,可以初步缩小相关线索的范围,以便在mps中进一步测试[9,39].
必须通过展示细胞对铅的反应以及铅对COVID-19细胞模型的表现来确认铅的治疗潜力。对于肺MPS来说,体外模拟SARS-CoV-2感染需要表达ACE2及其共受体跨膜蛋白酶丝氨酸2 (TMPRSS2)的肺细胞的存在。这两种受体在II型肺泡细胞中表达最高(AT2/AEC2) [40,41].通过验证抗体和mRNA测序,发现ACE2在肠微绒毛、肾近端小管、胆囊上皮以及睾丸支持细胞和间质细胞中表达[42].与测序数据一致的是,与SARS-CoV2相关的Vero、Caco-2和Huh-7.5细胞分别起源于肾、肠和肝,感染SARS-CoV和其他与SARS-CoV2相关的β冠状病毒[43].令人惊讶的是,在经常研究的肺上皮细胞系A549中未检测到ACE2的表达[42].虽然ACE2已经有了大量的研究,但也发表了使用CD147/basigin研究ACE2独立病毒进入的有争议的报道[44,45].肺泡II型细胞原代培养用于上皮离子转运的早期研究[46].当在Transwell培养中使用的多孔底插入物中生长时,这些细胞形成紧密连接(反映在高的跨上皮阻力,TEER),极化,并显示亚米洛利特敏感钠+运输(47].最早的培养物随时间迅速去分化,在超微结构上类似于I型肺泡细胞[48].下面将介绍几种防止这种去分化的方法[49,50,51,52,53,就超微结构和表面活性剂的产生而言,最有效的方法可能是使用空气界面[54].然而,这种方法对阿米洛利敏感钠的影响很小+运输(55,这与对分离的I型细胞的研究是一致的,因为它们也具有这种运输过程所需的器官[56,57].目前还没有从I型细胞中培养出来,但是已经从人类肺泡上皮中培养出了类似于它们的细胞系hAELVi [58].在设计模型时,应包括与被评估化合物相关的细胞,但应注意不要包括过多的外部细胞类型,这可能会使模型不必要地复杂化。
mps相关方法也被用于非肺细胞的COVID感染模型。一个这样的例子是人类重组可溶性ACE2 (hrsACE2)作为一种潜在的治疗SARS-CoV-2感染的生物疗法的试验,它通过与病毒刺突蛋白结合,阻断其与细胞ACE2的相互作用发挥作用。在Vero细胞培养和肾类器官中,感染降低了几个数量级(表1)[59].使用与sars - cov -2中和单克隆抗体类似的策略,防止了仓鼠的肺部病理[60].与丝氨酸蛋白酶抑制剂甲磺酸卡莫司他靶向TMPRSS2共受体被认为是阻止病毒进入细胞的进一步潜在手段[61].有趣的是,雌激素介导的ACE2上调可部分缓解ACE2表达细胞耗尽引起的炎症,这可能解释了死亡率的性别差异,并使雌激素成为COVID治疗方案的一个组成部分[62].用于类类固醇小分子时,MPSs需要的独特修饰(汇总于表1)在"当前的挑战和未来的展望”。
锌和锌金属酶是抗SARS-CoV-2进入药物开发的进一步替代靶点。促进锌进入是氯喹和羟氯喹的拟议机制,这两种有争议的抗疟药物被用于COVID-19治疗,是团结试验的一部分。作为一个离子载体,它们可以增加细胞内溶酶体锌的浓度,这已经被证明可以抑制病毒RNA依赖的RNA聚合酶[63,64].它们还会提高溶酶体的pH值,从而阻止溶酶体的酸化和与核内体的融合[65].这些药物也会损害ACE2的末端糖基化,影响其配体结合能力[65,66].尽管有这些有希望的细胞生物学证据,抗疟药在选择性临床试验中并没有显示出临床效益[67],这促使需要提高目前临床前测试方法的复杂性。其他抗病毒药物以细胞进入后的病毒复制为目标,如瑞德西韦,这是一种针对埃博拉病毒的RNA聚合酶抑制剂,或利托那韦和洛匹那韦,这是艾滋病毒蛋白酶抑制剂[65,68].组织蛋白酶介导的病毒蛋白切割加工也是一个正在研究的潜在药物靶点,某些化合物显示具有抗病毒作用[65,69].上述提到的一些药物也可以受益于纳米药物传递修饰,以提高它们的生物利用度和靶向性[70,71].药物组合也可能具有协同作用,对克服SARS-CoV-2感染可能至关重要[72,73].当设计用于药物组合的肺MPS时,考虑到“”中讨论的设计方面的每个成分药物是很重要的。COVID-19的生理和病理相关肺模型”和“当前的挑战和未来的展望”。
炎症
COVID-19的炎症成分是血管结缔组织中对SARS-CoV-2感染的复杂反应。由于病毒感染,细胞向细胞外基质迁移的顺序发生了,这个顺序从中性粒细胞开始,然后是淋巴细胞和巨噬细胞[74,75].炎症也继续在急性晚期/中期发生的肺水肿中发挥作用(图。2)时,体液和血浆蛋白随后伴随着免疫细胞渗出到细胞外基质。抗炎治疗通常用于防止炎症的有害影响,包括纤维化。与含有相同类型细胞的单一培养装置相比,气道芯片模型中炎症细胞因子在刺激下的释放更高,从而提供了MPS中促炎串扰的证据[76,77].细胞因子风暴或细胞因子释放综合征(CRS)是一种强大的细胞因子释放反应,导致高炎症状态,可导致危及生命的急性呼吸窘迫综合征(ARDS) [78].由细胞死亡碎片产生的类艾二十烷,如前列腺素和白三烯,可能是COVID-19中出现的细胞因子风暴的触发器[79].巨噬细胞激活综合征(MAS)和噬血细胞淋巴组织细胞病(HLH)是与COVID-19中细胞因子释放异常密切相关的自身免疫功能障碍[80,81,82].肿瘤坏死因子α (TNF-α)是一种由巨噬细胞释放的促炎细胞因子,可引起COVID-19血管渗漏、水肿和肺损伤。因此,用TNF-α抑制剂如依那西普(TGFR与IgG1 F的融合蛋白)治疗MASc)正在探索[80,83,84,85].阻断toll样受体4 (TLR-4)的刺突蛋白的交叉特异性被认为是使用TLR-4拮抗剂(如厄立托兰)对抗TNF-α-介导的细胞因子风暴的一种机制[86,87].COVID继发机会性感染的风险增加了对免疫调节剂和其他生物制剂的警惕[80,83,88].Sphingosine-1-phosphate (S1P)是肺早期先天免疫反应的鞘脂第二信使,抑制TNF-α的分泌可减少伴随的细胞因子风暴。鞘氨醇-1-磷酸受体(S1PR)拮抗剂fingolimod(图。4a2、表1)正在进行COVID-19的II期临床试验[78,89].另一种重要的细胞因子是IL-6,它与细胞表面的IL-6受体结合,并磷酸化janus相关激酶/信号转换器转录蛋白激活因子(JAK/STAT)通路中的介质,从而导致促炎细胞因子的进一步上调[89].Tocilizumab和sarilumab(表1)是靶向IL-6受体并拮抗其配体结合的单克隆抗体免疫抑制药物[80,82,89].Baricitinib ruxolinitinib(无花果。4a1,表1)和托法替尼是抑制细胞内JAK/STAT通路的小分子免疫抑制剂,已被建议用于治疗covid -19相关的HLH [80,81,83,89,90].IL-6介导的炎症也被认为与严重COVID-19非幸存者中发现的铁蛋白水平升高密切相关[91,92,93].IL-12与IL-6相似,是促炎细胞因子;因此,也有人建议使用IL-12抑制剂如ustekinumab治疗[83,85].另一方面,IL-10的存在表明炎症修复阶段的开始,并与非炎症性巨噬细胞2型(M2)状态相关,而它的循环水平也在细胞因子风暴中升高[84,85].在RECOVERY试验中,皮质类固醇地塞米松(表1)可降低ICU患者的死亡率,缩短非ICU患者的住院时间。有人建议使用地塞米松纳米药物制剂治疗COVID-19,因为其抗水肿和抗纤维化特性证明了改善循环时间和靶向性。在多发性骨髓瘤的临床试验中,聚乙二醇化脂质体地塞米松耐受性良好[94].为了有效地模拟肺MPS的炎症,包括细胞因子、t细胞、中性粒细胞和其他免疫细胞将可能捕捉到更复杂的类似于体内病理的现象。肺部免疫作用的长度模型包含在"模拟肺部的免疫反应”。
凝固
促炎细胞因子的增加会激活凝血反应级联,导致COVID-19患者凝血功能障碍。COVID-19凝血功能障碍具有脓毒症引起的凝血(SIC)和严重弥散性血管内凝血(DIC)的特点[95,96].COVID-19轻度延长凝血酶原时间(PT)和部分凝血酶活时间(aPTT),并显著升高d -二聚体。活性凝血指标与DIC重叠但不直接一致,提示存在明显的高凝状态[97],也被称为covid -19相关凝血功能障碍(CAC) [92].集成微流控检测止血参数[98]是MPS模型的设计考虑因素,其中包括凝血功能障碍。静脉血栓栓塞(VTE)和肺栓塞(PE)是COVID-19患者死亡的重要原因,被认为是由凝血功能障碍引起的,并被长时间卧床等因素进一步加剧[96,97,99].预防性使用抗凝药物包括组织型纤溶酶原激活剂(tPA)、直接口服抗凝药物、双嘧达莫、埃库利珠单抗和肝素类药物,如UFH、依诺肝素或达尔替帕林(表)1)[95,96,97,99,One hundred.].肝素也有抗炎作用[93],但其作用机制可能涉及肝素结合和细胞因子分离,目前尚不清楚。凝血酶激活PAR-1,增强炎症反应,从而减少抗凝血酶等生理性抗凝剂,从而加剧凝血障碍[101].在血栓形成的肺泡MPS模型中,使用脂多糖(LPS)内毒素诱导上皮层的血栓前细胞因子级联,检测PAR-1抑制剂parmodulin-2 (PM-2,表1)证明其有细胞保护和抗血栓活性[77,102].
肺水肿
在平衡状态下,从肺泡中主动排出的液体等于由于斯特林力而流入的液体,而肺泡腔内液体的深度约为0.1µm [103].Amiloride-sensitive Na+吸收推动液体从肺泡腔排出[104].阴离子(主要是氯- - - - - -)跟随主动吸收的那+,导致局部渗透梯度穿过上皮细胞,水沿着这一梯度流动,这主要发生在具有最高渗透性的所有细胞类型的肺泡I型细胞[105].值得注意的是,虽然人诱导多能干细胞(iPSC)来源的肺泡上皮细胞表达顶端标记物,如人I型细胞相关蛋白56 kDa (HTI-56)和人II型细胞相关蛋白280 kDa (hti -280),但它们的水通道蛋白表达是不同的[106,107].然而,如果上皮细胞完全受损,或者其紧密连接过度渗漏,则产生的梯度被淹没,发生水淹。表面活性剂功能的丧失也会导致肺泡浸润[108].针对IL-2治疗肺癌产生肺水肿的肺芯片研究表明,TRPV4离子通道调节肺泡毛细血管屏障[109].TRPV4抑制剂GSK27987451)正在进行一期临床试验,并已被建议用于治疗COVID-19肺水肿[110].
纤维化
病毒诱导的肺纤维化会导致肺功能立即下降,并增加肺纤维化的风险[111].肺内的上皮细胞可以在组织损伤后增殖,再生原生肺泡结构。然而,炎症或严重损伤会导致激活成纤维细胞的前炎症信号,成纤维细胞在肺组织内异常迁移和扩张,沉积坚硬、富含胶原的ECM [112].上皮细胞凋亡和纤维疤痕组织的积累共同抑制了正常的肺功能,共同促进了慢性症状。纤维化机制应纳入肺芯片系统,以更真实地模拟体内对病毒诱导损伤的反应,并更好地预测再生结果[113].对于治疗评估,肺芯片模型通常使用吡非尼酮和/或尼达尼的组合来修复肌成纤维细胞ECM的产生,有趣的是,这些已经被考虑作为潜在的COVID-19治疗方法[111].
纤维化表型通常通过在I型胶原基基质中添加肺成纤维细胞群和纤维化激活过程(TGF-β补充)来实现,并可以根据系统的不同以不同的方式进行量化。在一种方法中,人类小气道上皮细胞(SAECs)与内皮细胞和正常肺成纤维细胞结合在多层可渗透的PDMS装置中,该装置具有独特的设计,促进细胞与细胞的相互作用[114].通过添加肺纤维化患者来源的成纤维细胞和/或TGF-β诱导纤维化表型,并通过平滑肌肌动蛋白(α-SMA)、Tub4和俱乐部细胞子宫红蛋白(CC10)染色的变化进行表征。不同的定制方法利用丝质胶原蛋白支架能够模拟纤维化疾病进展中观察到的肺组织中成纤维细胞的硬化和排列;α-Al、ED-A纤维连接蛋白和periostin用于鉴定肌成纤维细胞群的生成[115].在一种研究纤维化硬化的替代方法中,Asmani等人开发了一种微post系统来保存上皮-成纤维细胞微组织。可通过对拉伸反应的相对位移来确定组织的刚度和顺应性[116].TGF-β诱导后,组织刚度增加了5倍,这是由α-SMA和前胶原蛋白增加介导的。利用该平台,基于TGF-β诱导的时间,吡非尼酮和尼替达尼被评估为预防和治疗纤维化的选择。根据他们模型的标记和力学评估,显著地发现特定剂量的吡非尼酮(5.3 mM)能最好地抵消纤维化组织表型。
模拟肺部的免疫反应
肺内先天和适应性免疫细胞的协同反应提供抗菌、抗真菌和抗病毒免疫,是重要的旁分泌信号来源。在肺实质组织中,局部巨噬细胞和淋巴细胞分别占效应免疫细胞的90%和10% [117].肺泡巨噬细胞非特异性摄取外来颗粒,如果发现病原体,则负责将抗原传递给淋巴结(APCs)中的淋巴细胞。在抗原存在的情况下,巨噬细胞产生的趋化因子通过将淋巴细胞招募到炎症的特定位置来激活适应性免疫[86].组织驻留的细胞毒T细胞在抗病毒免疫中起关键作用,与SARS-CoV-2感染治疗研究直接相关。适应性反应类型是由免疫调节细胞因子分泌谱定义的。T辅助细胞1 (IL-2、IFN-γ、TNF-α和GM-CSF)或T辅助细胞2 (IL-4、IL-5、IL-9、IL-10和IL-13)反应的诱导会影响随后激活的细胞数量、病原体清除机制和组织损伤类型[118].肺上皮细胞对刺激抗原反应时分泌的免疫调节因子在确定免疫反应程度方面也起着至关重要的作用[119].
最近的研究旨在在肺芯片系统中重建特定的免疫上皮细胞相互作用,以更好地模拟内在行为。在一项特定的研究中,初级支气管或小气道上皮细胞被播种在胶原包被的Transwell膜上,并在气液界面灌注下培养,分别创建成熟的上呼吸道或下呼吸道模型[120].将抗原提呈细胞,即树突状细胞或巨噬细胞,以及真菌病原体接种到细胞膜上,以评估这些免疫细胞在上皮网络内的反应。在该模型中,病原体的存在迅速增加了上皮RANTES和IL-8的表达(30分钟内),诱导树突状细胞成熟和通过组织迁移,并导致巨噬细胞吞噬。这个模型可以扩展到其他空气传播病原体的感染和随后的免疫反应评估[121,122].在另一种方法中,Benam等人将成熟的气道上皮细胞纳入气-液界面和将分化的上皮细胞与微流体装置内的流动介质分离的内皮层[76].在这个模型中,中性粒细胞可以通过介质通道引入,并可以评估由此产生的对内皮膜的粘附。将模拟多胞苷酸的病毒RNA传递到成熟的装置中会增加RANTES、IL-6和IP-10的水平,当上皮细胞和内皮细胞同时存在时,这些水平显著升高,这说明肺血管在更紧密地模拟固有免疫反应方面的重要作用。该系统应用于慢性阻塞性肺疾病(COPD)上皮细胞il -13诱导的哮喘或pla诱导的呼吸道感染模型,用于评估治疗方法。这些治疗的主要目标是降低慢性阻塞性肺病患者的免疫系统过度激活程度。观察到的中性粒细胞黏附减少、黏附标志物mRNA水平和炎症分泌足以证明布地奈德治疗之间的差异(图。4a3),被认为是临床上对COPD无效的,以及一种新型的含溴域蛋白4 (BRD4)抑制剂[76].该肺装置进一步扩大,以模型诱导炎症环境病毒感染哮喘患者。将细胞种子膜的孔径增加到3µm,可以评估流动中性粒细胞的迁移情况。根据细胞重塑、细胞因子分泌的时间测量(独立于上皮层和介质流出测量)和中性粒细胞行为评估il -13诱导的哮喘表型和人鼻病毒16感染引起的变化。该平台足以捕捉哮喘患者改变的免疫反应,并评估减少中性粒细胞迁移治疗的疗效[123].
支气管相关的淋巴组织存在于细支气管内,是B细胞和T细胞聚集、抗原呈递、活化和随后分化的局部部位[117].这一过程依赖于气道上皮内的髓系和浆细胞样树突状细胞,这些细胞吞噬抗原,并在被激活后迁移到淋巴结以呈递抗原[118,124,125].已有研究探索了使用浆细胞样树突状细胞分泌的干扰素来对抗SARS-CoV和SARS-CoV-2对先天免疫的抑制[126,127].有趣的是,干扰素诱导的胆固醇羟化酶被证明可以阻止病毒复制[128,而另一项研究认为胆固醇对病毒进入很重要[129].人工淋巴结的结构和功能已经通过独立开发的平台进行了设计,通常是通过在流动条件下将免疫细胞包裹在水凝胶基质中来实现[130].划分的树突状细胞、B-细胞和t细胞群[131],抗原呈递及淋巴细胞活化[132],以及从病人来源的细胞产生疫苗介导的抗体反应[133]已在各种模型中得到验证。在肺芯片模型中引入相关的免疫细胞和次级淋巴样组织,将提供对抗原和治疗的更多生物学相关反应,与内源性细胞类型的相互作用,并使通过体外生成抗原特异性抗体和记忆淋巴细胞的疫苗开发研究成为可能。
COVID-19的生理和病理相关肺模型
设计标准
为了最好地评估COVID-19及其相关组织损伤的治疗方法,肺模型的开发必须结合设计标准,包括:(1)原生组织结构和功能以及(2)疾病特异性或多疾病病理。基于我们对相关科学文献的回顾,我们认为模块化的肺MPS平台是最有前途的候选者,因为它能够结合多种细胞类型、生化和生物物理刺激,以及在3D微环境中不同的表征和输出参数[12].根据以往的报道,为了诱导天然肺组织中明显的多细胞分化,建议成分包括:气液界面、液体流动和拉伸刺激下的肺气道上皮细胞、内皮细胞和胶原基质。使用PDMS或其他材料来放置具有微米级特征的组织,已证明在集成单回路或多回路微流体器件方面取得了一致的成功。正在进行的工作旨在使这些设备易于在商业规模下制造,具有更高的现场时空分析吞吐量,并从患者来源的细胞类型。
如前所述,整合SARS-CoV-2病毒进入、免疫反应和疾病特异性病理的新模型将是评估早期到晚期感染治疗的最佳选择。第一步是使用肺原代细胞(如肺泡II型)或平衡ACE2和TMSPR2表达的生理相关性的细胞系。炎症和免疫功能可以通过外源性细胞因子(TNF-α, IL-6, IL-12),巨噬细胞,中性粒细胞和/或淋巴细胞引入。一个关键的设计成分,通过膜孔或分隔,是免疫细胞迁移和成熟的能力,以对肺组织细胞产生直接和旁分泌的影响。我们之前讨论了COVID-19最常见的并发症,即凝血、肺水肿和纤维化。相应的疾病特异性表型可以通过生化刺激(LPS, IL-2,或TGF-β,分别),额外的细胞类型,遗传修饰,或材料硬度的改变来引入和建模。多种疾病要素的直接集成或电路连接应允许以更高通量的方式进行治疗干预和可量化的疾病结果,以进行治疗评估。
将这些复杂的系统整合到一个单一的组织模型中是一个巨大的挑战。然而,COVID-19目前正在影响相当大一部分人口,其长期副作用相对未被探索,因此有理由采取这些措施。因此,一个理想的系统可以准确地确定每个疾病阶段的有效治疗方法,预计将产生重大影响。
肺MPS在多系统MPS中的应用
虽然肺微生理系统在测试COVID发展导联方面发挥着重要作用,但将肺MPS装置与多器官MPS或体片接口,对于确定继发性和系统性影响是必要的[134].心脏毒性和肝毒性等全身不良反应是导致上市后停药的主要原因[135].在多器官MPS中检测化合物可以捕捉到仅肺MPS或独立MPS设置所忽略的不良影响。肺MPS可以纳入到模拟肝脏、心脏、胰腺、肠道、肾脏、内皮细胞和大脑的MPS中[136,137,138].这对于检测COVID-19治疗方法尤其重要,因为心脏代谢共病会加剧疾病的严重程度。il -6介导的炎症在covid -19衍生的细胞因子风暴和心脏、肾脏、胰腺和全身血管的心脏代谢病理中发挥作用[87].在生成多器官MPS时,必须考虑添加剂成分的异速缩放[137,139].在器官和内皮代表全身血管的组合中,基于细胞数量的尺度比表面积计算的尺度具有更好的代谢性能[139].还应努力使每个腔室的药物吸收指标与黏液分配系数和粘膜上皮通透性等指标相一致[140].此外,与生理参数(如TEER)相关的测量将允许细胞类型之间的互换,并易于引入额外的器官系统间隔。
当前的挑战和未来的展望
创建COVID-19体外感染模型的过程面临着独特的挑战。首先,细胞成分需要仔细选择。例如,SARS-CoV-2感染会导致细胞损伤和异常的免疫反应,导致MPS血管腔内的微环境变化,包括葡萄糖升高、肌酸酐升高和细胞碎片导致的整体蛋白水平显著增加[141].尽管商业培养基配方包括高糖变异体和升高的蛋白可以通过血清热失活复制,但肌酸酐在体外常被忽视。有证据表明TLR-4 (Table1)在RAW 264.7巨噬细胞中可因肌酐水平升高而下调[142].其他考虑包括所选择的细胞类型是否以足够的量表达目标通路中的分子以供检测,或者细胞是否需要进一步操作[22,23,24].除了确保MPS选择的细胞内源性表达目标途径的所有成分外,它们还必须能够增殖,并在MPS微环境的底物上实现所需的表型和组织结构。
另一方面,MPS的生物物理特性应该模拟体内组织环境。例如,肺MPS模型各组分的弹性存在显著差异,包括PDMS侧壁、支撑肺泡上皮和内皮层基膜的物质,以及细胞本身及其沉积的ECM。因此,应该考虑到这些成分的弹性随着疾病状态的变化而变化。肺弹性是由弹性蛋白含量、模式和胶原同型的水平决定的[143,144,145,146,147,148].ECM的重组和重构依赖于基质金属蛋白酶(MMP),而基质金属蛋白酶(MMP)受组织抑制金属蛋白酶(TIMP)调控[144,149,150与胶原蛋白的关系比弹性蛋白大得多[145].改变底物弹性的能力在COVID模型中尤其重要,因为ARDS诱导了由巨噬细胞启动并由肌成纤维细胞继续的特定模式的肺重塑[144], ECM变硬是间质纤维化、肺泡间隔细胞丧失和间隔变薄引起的衰老特征[115,116,143,151].ECM的结构也影响炎症的调节,因为ECM的孔径大小可以影响巨噬细胞M1/M2的分化[152].改变MPS肺ECM的一种方法是使用动态可调的生物材料,以实现对机械性能的无创和时间控制[153,154,155].此外,还可以开发高通量平台,对各种条件(弹性、微观/宏观结构和化学成分)进行并行比较,以模拟生理和病理条件下的变化和功能差异。
MPS材料的表面性能也需要考虑。聚二甲基硅氧烷具有许多令人满意的特性,如透明性、透气性、柔韧性、易于制造的装置以及生物降解性[156].然而,未聚合的低聚物浸出、小分子吸收、蛋白质吸附到疏水表面和生物污垢等问题可能会限制其在MPS模型中用于筛选候选药物的使用。很大一部分未聚合的低聚物可以通过索氏提取或热老化去除[156,157].小分子的表面结合(200-400 kDa)具有良好的特征,主要由分子的辛醇-水分配系数(LogP > 4)决定。溶胶-凝胶法和对苯二甲酸涂层可以减少亲脂分子的吸收[156,157].Langmuir-Freundlich等温线[158,159是一种有用的定量技术,用于预测在测试特定铅时可能遇到的浓度范围内的通道吸附。Langmuir-Freundlich等温线由以下公式描述:
在哪里问e(mg/g)为化合物(溶质)吸附量,问米(mg山梨酸盐/ g吸附剂)为最大吸附量,K一个(L/mg)为吸附亲和常数,Ce表示平衡时的浓度(mg/L)和n表示地表非均质性指数。这种关系是半经验的,允许在一个功能性MPS中聚集复杂的效应。具有较低药物结合度的替代材料,如聚砜、聚碳酸酯和热塑性塑料,也可用于替代PDMS [160,161].生物制剂,如抗体和各种其他蛋白质可以吸附到未经处理的PDMS表面,这降低了分析物的浓度[162,163,164].常用氧等离子体或其他高能方法来增加亲水性;然而,该过程是短暂的,表面在15分钟内恢复[157,161].PDMS的长期表面钝化可以通过物理吸附两亲分子、自组装单分子膜的共价改性或接枝亲水聚合物来实现,如聚乙二醇(PEG)、聚(n -异丙基丙烯酰胺)(PNIPAAm)或2-羟乙基甲基丙烯酸酯(HEMA) [161].还可以应用多种涂层;PDMS表面涂有聚电解质多层膜(PEM)和随后的PEG共价附着,导致大鼠血清对蛋白质吸附的抗性长达5个月[157].替代材料也可以减少生物污染。有前景的弹性体,如ptcb -异龙脑基,通过其亲水性和与PDMS相当的机械性能,表现出优异的抗生物污染性能[162].
微流体流动的概念基础,即通过分岔的微米尺度通道驱动小体积,很容易应用于高通量筛选。在早期癌症建模芯片系统中,以10 × 10阵列排列的100孔HeLa细胞对微流体生成的分析物浓度梯度进行剂量-反应分析[163].最近,在一个设备上已经制造了多达4000孔的细胞[164].然而,许多这样的系统是单一培养,缺乏复杂的组织结构,这是有效的体外肺模型的重要。人类ipsc来源的肺类器官最近被用于筛选阻断SARS-CoV-2病毒进入ace -2表达细胞的药物。研究表明,伊马替尼、霉酚酸和二盐酸阿平抑制病毒感染[165].如前所述,我们将上气道MPS模型复用到96个孔中以筛选抗纤维化药物。这种MPS装置重建了空气-液体界面,给组件细胞一个生理上精确的微环境[115].MPS设备中的无泵和泵驱动微流体本质上简化了液体处理的瓶颈步骤,而将MPS与自动化液体处理和连续流动的最新进展相结合,可以进一步提高吞吐量[166,167,168],以及促进生物遏制以研究病毒性疾病[138].
人工智能(AI)在加速药物开发和再利用方面的作用是一个引人关注的领域。在其他与covid -19相关的领域,人工智能和机器学习已被证明对分子设计、数据挖掘和图像分析等应用很有用[169].卷积神经网络(CNN)图像分析可用于未固定和染色的MPS中特征性病毒细胞病理的检测[170].整合这种使能技术可能会加速肺MPS实验的产量。人工智能用于药物组合的协同效应是一个积极探索的话题[74,171].利用图形处理单元(GPU)的方法加速了分子对接研究[9,他们的准确性仍然依赖于所使用的评分功能。人工智能算法,如随机森林和神经网络的使用,提高了评分函数的准确性,并使蛋白质配体对的快速和准确检测取得进展[166,172].人工智能已被应用于确定配体与SARS-CoV-2蛋白的亲和力,尽管人工智能也可用于预测给定药物的毒性,通过对公开的毒性数据集(TOXNET或ToxCast)和经验或结构计算的分子描述符进行训练[173].对抗性自编码器(AAE)算法已被用于基于现有模板和期望的基因表达谱设计新的抑制剂[174].尽管人工智能非常强大,但在药物开发中,人工智能的支持者正试图克服许多障碍[175].数据驱动药物开发的可靠策略包括整合体外临床前验证[176].一种轻量级的体外人工智能验证方法,即肺MPS装置,必将有助于加速针对当前大流行的药物开发。
结论
MPS用于了解肺部生理和疾病状态的应用正在迅速扩大。它们与其他共培养系统(如类器官和Transwell系统)在药物发现方面的作用,更紧密地跟随体内生理和病理学,应该会成为下一个上升趋势。有效地调整这些体外模型以开发和表征COVID-19治疗方法,可能会使患者获得前所未有的好处,并为未来的准备奠定基础,因为全球联系日益增强可能会导致与当前冠状病毒疫情类似甚至更大的流行病。
参考文献
- 1.
Dong E, Du H, Gardner L(2020)实时跟踪COVID-19的交互式网络仪表板。柳叶刀感染Dis 20:533-534https://doi.org/10.1016/s1473 - 3099 (20) 30120 - 1
- 2.
赵艳梅,尚艳梅,宋文彬等(2020)COVID-19幸存者康复3个月后肺功能及相关生理特征的随访研究。EClinicalMedicine 25:100463。https://doi.org/10.1016/j.eclinm.2020.100463
- 3.
Atkins JL, Masoli JAH, Delgado J等人(2020)在英国生物库社区队列中预测COVID-19和死亡率。中国生物医学工程学报。https://doi.org/10.1093/gerona/glaa183
- 4.
Kaseda ET, Levine AJ(2020)创伤后应激障碍:COVID-19幸存者的鉴别诊断考虑。中国Neuropsychol 34:1498 - 1514。https://doi.org/10.1080/13854046.2020.1811894
- 5.
Mazza MG, De Lorenzo R, Conte C等人(2020)COVID-19幸存者的焦虑和抑郁:炎症和临床预测因素的作用。脑行为Immun 89:594-600。https://doi.org/10.1016/j.bbi.2020.07.037
- 6.
Nicola M, Alsafi Z, Sohrabi C等人(2020)冠状病毒大流行(COVID-19)的社会经济影响:综述。国际J外科78:185-193。https://doi.org/10.1016/j.ijsu.2020.04.018
- 7.
2019冠状病毒病(COVID-19)对世界经济的经济影响。SSRN 23。https://doi.org/10.2139/ssrn.3557504
- 8.
2019冠状病毒病对美国经济有什么影响?粗略估计Dis场景NBER。https://doi.org/10.3386/w26867
- 9.
LeGrand S, Scheinberg A, Tillack AF, Thavappiragasam M, Vermaas JV, Agarwal R, Sedova A (2020) gpu加速药物研发,与峰会超级计算机对接:移植、优化和应用于COVID-19研究。第11届美国计算机协会生物信息学、计算生物学和健康信息学国际会议论文集,第1-10页
- 10.
McDonald KA, Holtz RB(2020)从农场到手指刺——植物如何帮助抗击COVID-19的观点。Front Bioeng biotechnology 8:1-5。https://doi.org/10.3389/fbioe.2020.00782
- 11.
Kowalewski J, Ray A(2020)在1000万化学空间中使用机器学习预测SARS-CoV-2的新药物。Heliyon 6: e04639。https://doi.org/10.1016/j.heliyon.2020.e04639
- 12.
Konar D, Devarasetty M, Yildiz DV,等(2016)疾病建模和药物开发的肺芯片技术。生物工程计算机生物7s1:BECB.S34252。https://doi.org/10.4137/BECB.S34252
- 13.
Benam KH, Dauth S, Hassell B等人(2015)体外疾病模型工程。Annu Rev Pathol Mech Dis 10:195-262。https://doi.org/10.1146/annurev-pathol-012414-040418
- 14.
Low LA, Mummery C, Berridge BR等人(2020)芯片上的器官:进入下一个十年。Nat Rev Drug Discov(出版中)。https://doi.org/10.1038/s41573-020-0079-3
- 15.
Hiemstra PS, Tetley TD, Janes SM(2019)气道和肺泡上皮细胞培养。欧元呼吸指数J 54(5):1900742。https://doi.org/10.1183/13993003.00742-2019
- 16.
刘志强,刘志刚等(2019)微流控双分子层装置中上皮/内皮屏障的通透性。大10(8):533。https://doi.org/10.3390/mi10080533
- 17.
Yamaya M, Finkbeiner WE, Chun SY等(1992)人气管上皮细胞培养物的结构和功能分化。生理酚细胞Mol物理酚262(6):L713-L724。https://doi.org/10.1152/ajplung.1992.262.6.L713
- 18.
Sato T, Vries RG, Snippert HJ等(2009)单个Lgr5干细胞在体外构建隐窝-绒毛结构,不含间充质生态位。自然459(7244):262 - 265。https://doi.org/10.1038/nature07935
- 19.
Gkatzis K, Taghizadeh S, Huh D等(2018)使用三维类器官和肺芯片方法研究肺发育、再生和疾病。欧洲呼吸指数J 52(5):1800876。https://doi.org/10.1183/13993003.00876-2018
- 20.
D’costa K, Kosic M, Lam A等(2020)用于开发类器官和器官芯片模型的生物材料和培养系统。中国生物医学工程学报,29(5):732 - 732。https://doi.org/10.1007/s10439-020-02498-w
- 21.
Liu Z, Anderson JD, Deng L等(2020)人鼻上皮类器官用于囊性纤维化的治疗开发。基因(巴塞尔)11(6):603。https://doi.org/10.3390/genes11060603
- 22.
Schilders KAA, Eenjes E, Riet SV等人(2016)肺再生:肺干细胞和肺模拟装置的发展。Reet alspir Res 17(1):1 - 16。https://doi.org/10.1186/S12931-016-0358-Z
- 23.
Niemeyer BF, Kaiser AJ, Benam KH(2020)呼吸病理生理学:人肺微生理模型。见:Kim HJ(主编),仿生微工程。CRC出版社,第237-261页。
- 24.
Evans KV, Lee JH(2020)肺泡战争:了解人类肺泡维持、再生和疾病的体外模型的兴起。干细胞转化医学9(8):867-881。https://doi.org/10.1002/sctm.19-0433
- 25.
刘辉,王赟,崔凯等(2019)类器官和器官芯片水凝胶的研究进展。阿德板牙31(50):28。https://doi.org/10.1002/adma.201902042
- 26.
Shin W, Wu A, Min S,等(2020)Wnt的时空梯度和不稳定性诱导了人类肠道类器官的异质生长和分化。iScience 23(8): 101372。https://doi.org/10.1016/j.isci.2020.101372
- 27.
Mulay A, Konda B, Garcia G,等(2020)人原发性肺上皮SARS-CoV-2感染对COVID-19建模和药物发现的影响。bioRxiv prep Serv Biol pp 1-24。https://doi.org/10.1101/2020.06.29.174623
- 28.
Whitesides GM(2006)微流体的起源和未来。自然442(7101):368 - 373。https://doi.org/10.1038/nature05058
- 29.
Huh D, Matthews BD, Mammoto A等(2010)在芯片上重构器官级肺功能。科学》328(5986):1662 - 1668。https://doi.org/10.1126/science.1188302
- 30.
Stucki AO, Stucki JD, Hall SRR等(2015)一种集成生物呼吸机制的肺芯片阵列。实验室芯片15(5):1302 - 1310。https://doi.org/10.1039/c4lc01252f
- 31.
Majumdar A, Arold SP, Erzsébet BS等(2012)肺泡II型细胞拉伸诱导表面活性剂释放的干扰动力学。应用生理学报112(5):824-831。https://doi.org/10.1152/japplphysiol.00975.2010
- 32.
Nalayanda DD, Puleo C, Fulton WB等人(2009)用于气液界面肺特异性功能研究的开放式微流控模型。生物医学Microdev 11(5): 1081 - 1089。https://doi.org/10.1007/s10544-009-9325-5
- 33.
Mermoud Y, Felder M, Stucki JD等人(2018)微阻抗断层扫描系统,用于监测呼吸肺芯片中的细胞活动和膜运动。Sens Actuat B Chem 255:3647-3653。https://doi.org/10.1016/j.snb.2017.09.192
- 34.
Marx U, Akabane T, Andersson TB,等人(2020)生物启发的微生理系统,在药物开发中促进患者受益和动物福利。ALTEX 37(3): 364 - 394。https://doi.org/10.14573/altex.2001241
- 35.
Kim JY, Fluri DA, Kelm JM等(2015)基于96-Well格式的多细胞球体并行互联微流控平台。实验室自动化20(3):274-282。https://doi.org/10.1177/221106821456405636
- 36.
吴燕燕,林文华,徐建泰等(2006)抗sars冠状病毒的抗病毒药物发现。医学化学13(17):2003-2020。https://doi.org/10.2174/092986706777584988
- 37.
Benítez-Cardoza CG, Vique-Sánchez JL (2020) ACE2与SARS-CoV-2相互作用的潜在抑制剂(RBD),开发药物。生命科学256(6):117970。https://doi.org/10.1016/j.lfs.2020.117970
- 38.
谭强,金勇(2020)奥斯塔维米尔对COVID-19无效:硅评估、体外和回顾性研究。medRxiv: 2020.05.15.20102392。https://doi.org/10.1101/2020.05.15.20102392
- 39.
Das S, Sarmah S, Lyndem S等(2020)利用分子对接研究鉴定SARS-CoV-2主蛋白酶潜在抑制剂的研究。生物力学学报39(5):1-11。https://doi.org/10.1080/07391102.2020.1763201
- 40.
Lukassen S, Chua RL, Trefzer T等人(2020)SARS‐CoV‐2受体ACE2和TMPRSS2主要表达于支气管短暂分泌细胞。EMBO J 39(10): 1 - 15。https://doi.org/10.15252/embj.20105114
- 41.
赵燕,赵卓,王勇等(2020)SARS-CoV-2受体ACE2单细胞RNA表达谱分析。中华医学会呼吸与危重症医学分会202(5):756-759。https://doi.org/10.1164/rccm.202001-0179LE
- 42.
Hikmet F, Méar L, Edvinsson Å,等人(2020)ACE2在人体组织中的蛋白表达谱。Mol Syst Biol 16(7):e9610。https://doi.org/10.15252/msb.20209610
- 43.
Letko M, Marzi A, Munster V (2020) SARS-CoV-2和其他B系β冠状病毒细胞进入和受体使用功能评估。Nat Microbiol 5(4): 562 - 569。https://doi.org/10.1038/s41564-020-0688-y
- 44.
王凯,陈伟,张智等(2020)CD147-spike蛋白是SARS-CoV-2感染宿主细胞的新途径。信号转导目标5(1):283。https://doi.org/10.1038/s41392-020-00426-x
- 45.
Shilts J, Crozier TWM, Wright GJ等(2021)没有证据表明basigin / CD147是SARS - CoV - 2穗结合受体。Sci代表11(1):413。https://doi.org/10.1038/s41598-020-80464-1
- 46.
Mason RJ, Williams MC, Widdicombe JH等(1982)原代培养的肺泡II型细胞经上皮转运。PNAS 79(19): 6033 - 6037。https://doi.org/10.1073/pnas.79.19.6033
- 47.
金KJ,克里克JM,克兰德尔ED(1991)活性Na的贡献+和Cl-通过肺泡上皮进行净离子转运的通量。和杂志85(2):245 - 256。https://doi.org/10.1016/0034 - 5687 (91) 90065 - q
- 48.
Cheek JM, Evans MJ, Crandall ED(1989)致密肺泡上皮单层中的I型细胞样形态。实验单元号184(2):375-387。https://doi.org/10.1016/0014 - 4827 (89) 90337 - 6
- 49.
Borok Z, Hami A, Danto SI等人(1995)在体外大鼠血清可抑制肺泡上皮细胞向I型细胞表型发展。呼吸细胞Mol生物学12(1):50-55。https://doi.org/10.1165/ajrcmb.12.1.7811470
- 50.
Borok Z, Lubman RL, Danto SI等(1998)角质细胞生长因子在体外调节肺泡上皮细胞表型:水通道蛋白5的表达。呼吸细胞分子生物学18(4):554-561。https://doi.org/10.1165/ajrcmb.18.4.2838
- 51.
Danto SI, Shannon JM, Borok Z等(1995)肺泡上皮细胞可逆转分化。呼吸细胞分子生物学12(5):497-502。https://doi.org/10.1165/ajrcmb.12.5.7742013
- 52.
Kawada H, Shannon JM, Mason RJ(1990)成年大鼠肺泡II型细胞分化的体外改善维持:无血清、激素定义的培养基和重组基底膜的作用。呼吸细胞Mol生物学3(1):33-43。https://doi.org/10.1165/ajrcmb/3.1.33
- 53.
张欣,纪海林(2019)肺泡2型祖细胞在肺损伤修复中的作用。细胞死亡发现5(1):63。https://doi.org/10.1038/s41420-019-0147-9
- 54.
Dobbs LG, Pian MS, Maglio M等人(1997)通过顶端空气表面培养维持分化的II型细胞表型。肺细胞生理酚273(2):L347-L354。https://doi.org/10.1152/ajplung.1997.273.2.l347
- 55.
许江,王志强,王志强(2001)离子转运在成人肺泡上皮细胞肾上腺素能调节中的作用−具有顶部空气界面的培养物中通道的激活和运输功能。中国生物医学杂志,32(3):449 - 456。https://doi.org/10.1007/s00232-001-0022-4
- 56.
Johnson MD, Bao HF, Helms MN等(2006)肺泡I型细胞的功能离子通道支持I型细胞在肺离子转运中的作用。PNAS 103(13): 4964 - 4969。https://doi.org/10.1073/pnas.0600855103
- 57.
Johnson MD, Widdicombe JH, Allen L等人(2002)肺泡上皮I型细胞含有转运蛋白和转运钠,支持I型细胞在调节肺液体稳态中发挥积极作用。PNAS 99(4): 1966 - 1971。https://doi.org/10.1073/pnas.042689399
- 58.
Kuehn A, klet S, De Souza Carvalho-Wodarz C,等人(2016)表达紧密连接的人类肺泡上皮细胞来模拟空气-血液屏障。ALTEX 33(3): 251 - 260。https://doi.org/10.14573/altex.1511131
- 59.
Monteil V, Kwon H, Prado P等(2020)使用临床级可溶性人ACE2抑制工程人体组织中的SARS-CoV-2感染。细胞181 (4):905 - 913. - e7。https://doi.org/10.1016/j.cell.2020.04.004
- 60.
Kreye J, Reincke SM, Kornau H,等人(2020)一种SARS-CoV-2中和抗体对COVID-19仓鼠模型的肺病理学有保护作用。bioRxiv prep Serv Biol pp 1-69。https://doi.org/10.1101/2020.08.15.252320
- 61.
张慧,彭宁杰,李勇等(2020)血管紧张素转换酶2 (ACE2)作为SARS-CoV-2受体的分子机制和潜在治疗靶点。重症监护医师46(4):586-590。https://doi.org/10.1007/s00134-020-05985-9
- 62.
Penna C, Mercurio V, Tocchetti CG等人(2020)。中华药理学杂志177(19):4375-4385。https://doi.org/10.1111/bph.15207
- 63.
Derwand R, Scholz M(2020)补锌是否能增强氯喹/羟氯喹的临床疗效,赢得当今抗击COVID-19的战斗?假设142(4):109815。https://doi.org/10.1016/j.mehy.2020.109815
- 64.
Doboszewska U, Wlaź P, Nowak G等(2020)研究新型冠状病毒感染的锌金属酶。药理学报177(21):4887-4898。https://doi.org/10.1111/bph.15199
- 65.
胡泰,freeman M, Wolfram J(2020)纳米医学对氯喹抗COVID-19疗效的认识。Nat Nanotechnol 15(4): 247 - 249。https://doi.org/10.1038/s41565-020-0674-9
- 66.
Dalan R, bernstein SR, el - armour che A等人(2020)COVID-19中的ACE-2:敌人还是朋友?Horm Metab Res 52(5): 257-263。https://doi.org/10.1055/a-1155-0501
- 67.
Rakedzon S, Neuberger A, Domb AJ,等人(2021)从羟氯喹到伊维菌素:抗寄生虫药物对抗SARS-CoV-2的抗病毒特性是什么?中华医学杂志28(2):taab005。https://doi.org/10.1093/jtm/taab005
- 68.
Mainardes RM, Diedrich C(2020)纳米医学在COVID-19治疗中的潜在作用。其他Deliv 11(7): 411 - 414。https://doi.org/10.4155/tde-2020-0069
- 69.
Riva L, Yuan S, Yin X等(2020)通过大规模复合再利用发现SARS-CoV-2抗病毒药物。自然586(7827):113 - 119。https://doi.org/10.1038/s41586-020-2577-1
- 70.
Sundar S, Kumar Prajapati V(2012)表面特异生物分子功能化的纳米颗粒靶向感染性疾病的药物。医学化学19(19):3196-3202。https://doi.org/10.2174/092986712800784630
- 71.
Abd Ellah NH, Gad SF, Muhammad K等人(2020)纳米医学是诊断、治疗和预防COVID-19的一种有前景的方法。纳米15(21):2085 - 2102。https://doi.org/10.2217/nnm-2020-0247
- 72.
Nowak-Sliwinska P, Weiss A, Ding X等(2016)利用反馈系统控制优化药物组合。Nat Protoc 11(2): 302 - 315。https://doi.org/10.1038/nprot.2016.017
- 73.
Ho D(2020)用人工智能应对COVID-19药物开发。Adv Intell系统2(5):2000070。https://doi.org/10.1002/aisy.202000070
- 74.
Medzhitov R(2008)炎症的起源和生理作用。自然454(7203):428 - 435。https://doi.org/10.1038/nature07201
- 75.
Reinhart K, Bauer M, Riedemann NC等(2012)脓毒症的新方法:分子诊断和生物标志物。临床微生物学Rev 25(4): 609-634。https://doi.org/10.1128/CMR.00016-12
- 76.
Benam KH, Villenave R, Lucchesi C等人(2016)小气道芯片能够在体外分析人类肺部炎症和药物反应。Nat方法13(2):151 - 157。https://doi.org/10.1038/nmeth.3697
- 77.
许丹(2019)呼吸系统微生理模型。在:Cho DW(编辑),生物制造和3D组织建模,第279-293页。https://doi.org/10.1039/9781788012683-00279
- 78.
Suntharalingam G, Perry MR, Ward S等(2006)抗cd28单克隆抗体TGN1412的细胞因子风暴的一期试验。中国医学杂志355(10):1018-1028。https://doi.org/10.1056/NEJMoa063842
- 79.
Panigrahy D, Gilligan MM, Huang S等(2020)炎症解决:双管齐下的方法来避免COVID-19中的细胞因子风暴?肿瘤转移Rev 39(2): 337-340。https://doi.org/10.1007/s10555-020-09889-4
- 80.
Diamanti AP, Rosado MM, Pioli C等人(2020)COVID-19患者的细胞因子释放综合征,对一个老问题的新场景:感染和自身免疫之间的脆弱平衡。国际化学杂志21(9):1-18。https://doi.org/10.3390/ijms21093330
- 81.
Agarwal S, June CH(2020)利用CAR - t细胞的见解来开发COVID-19患者的过度炎症反应的治疗方法。癌症越是加大10(6):775 - 778。https://doi.org/10.1158/2159-8290.CD-20-0473
- 82.
alijoas - reig J, estev - valverde E, Belizna C,等人(2020)治疗严重COVID-19的免疫调节疗法。除了抗病毒治疗:一个全面的回顾。Autoimmun牧师19(7):102569。https://doi.org/10.1016/j.autrev.2020.102569
- 83.
王东,周伟,张锐等(2018)大尺寸无层状二维纳米片的大规模生产:快速“凝胶吹制”策略的定向合成及其在Li/Na存储和催化中的应用。阿德板牙30(43):1 - 11。https://doi.org/10.1002/adma.201803569
- 84.
Freeman TL, Swartz TH(2020)针对严重COVID-19中的NLRP3炎症小体。前面Immunol 11:1518。https://doi.org/10.3389/fimmu.2020.01518
- 85.
Mangalmurti N, Hunter CA(2020)细胞因子风暴:理解COVID-19。免疫(1):53 19-25。https://doi.org/10.1016/j.immuni.2020.06.017
- 86.
Martin TR, Frevert CW(2005)肺的先天免疫。Proc Am胸腔Soc 2(5): 403-411。https://doi.org/10.1513/pats.200508-090js
- 87.
Brandão SCS, de Ramos J, OX, Dompieri LT,等(2020)toll样受体4是否与心脏代谢共病患者的COVID-19病理严重程度有关?细胞因子生长因子Rev 58:102-110。https://doi.org/10.1016/j.cytogfr.2020.09.002
- 88.
Bashyam AM, Feldman SR(2020年)在COVID-19大流行期间,患者是否应该停止生物治疗。皮肤科杂志治疗31(4):317-318。https://doi.org/10.1080/09546634.2020.1742438
- 89.
Catanzaro M, Fagiani F, Racchi M等人(2020)COVID-19的免疫反应:通过靶向SARS-CoV-2触发的通路应对药理学挑战。信号转导目标5(1):84。https://doi.org/10.1038/s41392-020-0191-1
- 90.
Osei ET, Booth S, Hackett TL(2020)体外共培养模型告诉我们,上皮-间充质相互作用对哮喘气道炎症和气道重塑的贡献是什么?细胞9(7):1694。https://doi.org/10.3390/cells9071694
- 91.
黄I, Pranata R, Lim MA等人(2020)严重冠状病毒疾病-2019中的c反应蛋白、降钙素原、d -二聚体和铁蛋白:一项元分析。theradv Respir Dis 14:1-14。https://doi.org/10.1177/1753466620937175
- 92.
Gómez-Pastora J, Weigand M, Kim J等(2020)COVID-19危重患者的高铁蛋白血症——铁蛋白是炎症的产物还是致病介质?临床学报509:249-251。https://doi.org/10.1016/j.cca.2020.06.033
- 93.
Ehsani S (2020) COVID-19与铁失调:hepcidin与新型冠状病毒刺突糖蛋白的远端序列相似性。杂志直接15(1):1-13。https://doi.org/10.1186/s13062-020-00275-2
- 94.
Lammers SR, Kao PH, Qi HJ等(2008)高血压犊牛弹性蛋白结构-功能关系的变化及其对近端肺动脉力学的影响。Am J Physiol - Hear Circ Physiol 295(4): 1451-1459。https://doi.org/10.1152/ajpheart.00127.2008
- 95.
conors JM, Levy JH (2020) COVID-19及其对血栓和抗凝的影响。血135(23):2033 - 2040。https://doi.org/10.1182/blood.2020006000
- 96.
唐宁,白华,陈旭等(2020)抗凝治疗与2019年重症冠状病毒病合并凝血功能障碍患者死亡率下降相关。血液凝血18(5):1094-1099。https://doi.org/10.1111/jth.14817
- 97.
Aggarwal M, Dass J, Mahapatra M (2020) COVID-19止血异常:最新进展。印度输血杂志36(4):616-626。https://doi.org/10.1007/s12288-020-01328-2
- 98.
jiar Panchal H, Kent NJ, Knox AJS等(2020)微流体在止血中的应用综述。分子25(4):833。https://doi.org/10.3390/molecules25040833
- 99.
Llitjos JF, Leclerc M, Chochois C等(2020)抗凝重症COVID-19患者静脉血栓栓塞事件发生率高。J throm hamost 18(7): 1743-1746。https://doi.org/10.1111/jth.14869
- One hundred.
Harzallah I, Debliquis A, Drénou B(2020)狼疮抗凝剂在Covid-19患者中常见:反应对反应。J Thromb Haemost。https://doi.org/10.1111/jth.14980
- 101.
Jose RJ, Manuel A (2020) COVID-19细胞因子风暴:炎症与凝血的相互作用。柳叶刀呼吸医学8(6):e46-e47。https://doi.org/10.1016/s2213 - 2600 (20) 30216 - 2
- 102.
Jain A, Barrile R, van der Meer AD等(2018)主要的人类肺泡芯片血管内血栓形成模型,用于评估治疗方法。临床药典103(2):332-340。https://doi.org/10.1002/cpt.742
- 103.
Bastacky J, Lee CYC, Goerke J等(1995)肺泡内膜薄而连续:大鼠肺的低温扫描电镜。中国生物医学工程学报79(5):1615-1628。https://doi.org/10.1152/jappl.1995.79.5.1615
- 104.
Matalon S, Bartoszewski R, Collawn JF(2015)上皮钠通道在肺液稳态调节中的作用。Am J Physiol Lung Cell Mol Physiol 309(11): L1229-L1238。https://doi.org/10.1152/ajplung.00319.2015
- 105.
Dobbs LG, Gonzalez R, Matthay MA等人(1998)高水透性的I型肺泡上皮细胞赋予大鼠肺腔和血管之间高的水透性。PNAS 95(6): 2991 - 2996。https://doi.org/10.1073/pnas.95.6.2991
- 106.
Dorrello NV, Guenthart BA, O’neill JD等(2017)功能性血管化肺移植用于肺生物工程。Sci副词3 (8):e1700521。https://doi.org/10.1126/sciadv.1700521
- 107.
Ghaedi M, Calle EA, Mendez JJ等(2013)人iPS细胞来源的肺泡上皮在肺细胞外基质中再生。J临床投资123(11):4950-4962。https://doi.org/10.1172/JCI68793
- 108.
Günther A, Ruppert C, Schmidt R等(2001)表面活性剂在急性呼吸窘迫综合征中的改变和替代。和Res 2(6): 353 - 364。https://doi.org/10.1186/rr86
- 109.
Huh D, Leslie DC, Matthews BD,等人(2012)在肺芯片微型装置中药物毒性致肺水肿的人类疾病模型。中国生物医学杂志4(12):159ra147-159ra147。https://doi.org/10.1126/scitranslmed.3004249
- 110.
Kuebler WM, Jordt SE, Liedtke WB(2020)紧急重新考虑肺水肿作为COVID-19中可预防的结果:抑制TRPV4是一种有希望和可行的方法。Am J Physiol -肺细胞Mol Physiol 318(6): L1239-L1243。https://doi.org/10.1152/AJPLUNG.00161.2020
- 111.
George PM, Wells AU, Jenkins RG(2020)肺纤维化和COVID-19:抗纤维化治疗的潜在作用。柳叶刀呼吸医学8(8):807-815。https://doi.org/10.1016/s2213 - 2600 (20) 30225 - 3
- 112.
Beers MF, Morrisey EE(2011)肺健康和疾病的三个R:修复,重塑和再生。临床投资121(6):2065-2073。https://doi.org/10.1172/JCI45961
- 113.
Sacchi M, Bansal R, Rouwkema J(2020)生物工程3D模型再现组织纤维化。生物科技趋势》38(6):623 - 636。https://doi.org/10.1016/j.tibtech.2019.12.010
- 114.
Mejías JC, Nelson MR, Liseth O等人(2020)96孔格式的微血管化人类肺芯片平台,用于纤维化疾病的微生理建模。实验室芯片20(19):3601 - 3611。https://doi.org/10.1039/d0lc00644k
- 115.
Sundarakrishnan A, Zukas H, Coburn J等(2019)成纤维细胞活化体外组织模型用于肺纤维化建模。中国生物医学工程学报5(5):2417-2429。https://doi.org/10.1021/acsbiomaterials.8b01262
- 116.
Asmani M, Velumani S, Li Y等(2018)纤维化微组织阵列预测抗纤维化药物疗效。Nat Commun 9(1): 1 - 12。https://doi.org/10.1038/s41467-018-04336-z
- 117.
Agostini C, Chilosi M, Zambello R等人(1993)健康和疾病中的肺免疫细胞:淋巴细胞。欧元呼吸J 6(9): 1378-1401
- 118.
Curtis JL(2005)细胞介导的肺适应性免疫防御。Proc Am胸腔Soc 2(5): 412-416。https://doi.org/10.1513/pats.200507-070JS
- 119.
Whitsett JA, Alenghat T(2015)呼吸道上皮细胞协调肺先天免疫。Nat Immunol 16(1): 27-35。https://doi.org/10.1038/ni.3045
- 120.
Chandorkar P, Posch W, Zaderer V等人(2017)快速开发体外3D肺/免疫细胞模型来研究曲霉感染。Sci代表7(1):1-13。https://doi.org/10.1038/s41598-017-11271-4
- 121.
Morton CO, Wurster S, Fliesser M等人(2018)验证一个简化的体外肺泡表面Transwell®模型,以评估不同形态的烟曲霉诱导的宿主免疫。国际医学微生物学杂志308(8):1009-1017。https://doi.org/10.1016/j.ijmm.2018.09.001
- 122.
Schiefermeier-Mach N, Perkhofer S, Heinrich L,等人(2020)烟熏A. fumigatus对初级肺泡II型细胞表面活性剂胞吐的刺激作用。地中海Mycol 59(2): 168 - 179。https://doi.org/10.1093/mmy/myaa042
- 123.
Nawroth JC, Lucchesi C, Cheng D等人(2020)一种微工程气道肺芯片模型的病毒性哮喘加重的关键特征。中国生物医学杂志63(5):591-600。https://doi.org/10.1165/rcmb.2020-0010ma
- 124.
Maazi H, Banie H, Aleman Muench GR等(2018)活化的浆细胞样树突状细胞调节2型先天淋巴细胞介导的气道高反应性。变态反应临床141(3):893-905.e6。https://doi.org/10.1016/j.jaci.2017.04.043
- 125.
Lynch JP, Werder RB, Loh Z等人(2018)浆细胞样树突状细胞通过信号素4a介导的T reg扩张保护病毒性细支气管炎和哮喘。中华医学杂志215(2):537-557。https://doi.org/10.1084/jem.20170298
- 126.
Kuri T, Zhang X, Habjan M等(2009)干扰素启动使细胞部分推翻SARS冠状病毒诱导的先天免疫激活阻滞。J Gen病毒90(11):2686-2694。https://doi.org/10.1099/vir.0.013599-0
- 127.
张强,王鹏飞,刘震,等(2020)危及生命的COVID-19患者的I型干扰素免疫先天错误。科学》370 (6515):eabd4570。https://doi.org/10.1126/science.abd4570
- 128.
Zang R, Case JB, Yutuc E等(2020)胆固醇25-羟基化酶通过阻断膜融合抑制SARS-CoV-2复制。PNAS 117(50): 32105 - 32113。https://doi.org/10.1073/pnas.2012197117
- 129.
Sanders DW, Jumper CC, Ackerman PJ等人(2020)SARS-CoV-2病毒进入和病理合胞体形成需要胆固醇。bioRxiv。https://doi.org/10.1101/2020.12.14.422737
- 130.
Morsink MAJ, Willemen NGA, Leijten J等(2020)芯片上的免疫器官和免疫细胞:生物医学应用概述。大11(9):1 - 25。https://doi.org/10.3390/MI11090849
- 131.
Shanti A, Samara B, Abdullah A等人(2020)多室3d培养的器官芯片:迈向用于药物开发的仿生淋巴结。制药学12(5):464。https://doi.org/10.3390/pharmaceutics12050464
- 132.
Giese C, Lubitz A, Demmler CD等人(2010)体外人体淋巴类微生物器官免疫物质试验。生物科技J》148(1):38-45。https://doi.org/10.1016/j.jbiotec.2010.03.001
- 133.
Goyal G, Bausk B, Prabhala P等人(2019)在体外人体器官芯片中重构淋巴结滤泡形成和接种反应。BioRxiv。https://doi.org/10.1101/806505
- 134.
Ashammakhi N, Darabi MA, Çelebi-Saltik B等(2020)微生理系统:评估纳米材料毒性和治疗效果的下一代系统。小方法4(1):-。https://doi.org/10.1002/smtd.201900589
- 135.
Onakpoya IJ, Heneghan CJ, Aronson JK(2016) 462种药品因药物不良反应上市后召回:系统回顾世界文献。BMC医学14(1):1 - 11。https://doi.org/10.1186/s12916-016-0553-2
- 136.
Bovard D, Sandoz A(2020)如何构建你的多器官芯片系统:一个案例研究。见:Hoeng J, Bovard D, Peitsch MC(编辑),器官芯片:安全性和有效性测试的工程微环境pp 463-506。https://doi.org/10.1016/B978-0-12-817202-5.00015-2
- 137.
Edington CD, Chen WLK, Geishecker E等(2018)用于定量生物学和药理学研究的互联微生理系统。Sci代表8(1):队。https://doi.org/10.1038/s41598-018-22749-0
- 138.
Novak R, Ingram M, Marquez S等(2020)多血管化器官芯片的机器人流控耦合和审问。生物工程学报4(4):407-420。https://doi.org/10.1038/s41551-019-0497-x
- 139.
Ucciferri N, Sbrana T, Ahluwalia A(2014)多器官体外人体代谢模型的异速缩放和细胞比例。Front Bioeng biotechnology 2:74。https://doi.org/10.3389/fbioe.2014.00074
- 140.
Loftsson T(2015)黏膜被动转运。见:Loftsson T(主编),Essential pharmacokinetics, pp 81-83。https://doi.org/10.1016/b978-0-12-801411-0.00001-9
- 141.
杜燕,涂亮,朱鹏等(2020)武汉市85例新冠肺炎死亡病例临床特征回顾性观察研究。中国呼吸急救医学201(11):1372-1379。https://doi.org/10.1164/rccm.202003-0543OC
- 142.
Leland KM, McDonald TL, Drescher KM(2011)肌酸、肌酸和肌酸乙酯对巨噬细胞TLR表达的影响。Int Immunopharmacol 11(9): 1341 - 1347。https://doi.org/10.1016/j.intimp.2011.04.018
- 143.
Bou Jawde S, Takahashi A, Bates JHT等(2020)根据肺组织单轴应力-应变曲线估算肺泡壁弹性模量的分析模型。杂志11:121前面。https://doi.org/10.3389/fphys.2020.00121
- 144.
Ito JT, Lourenço JD, Righetti RF等人(2019)呼吸系统疾病的细胞外基质成分重构:在临床和实验研究中发现了什么?细胞8(4):342。https://doi.org/10.3390/cells8040342
- 145.
Dolhnikoff M, Mauad T, Ludwig MS(1999)博莱霉素诱导的大鼠肺实质纤维化的细胞外基质和振荡机制。中国呼吸急救杂志160(5):1750-1757。https://doi.org/10.1164/ajrccm.160.5.9812040
- 146.
Piechocka IK, Van Oosten ASG, Breuls RGM等(2011)异型胶原网络的流变学。Biomacromol 12(7): 2797 - 2805。https://doi.org/10.1021/bm200553x
- 147.
Mereness JA, Bhattacharya S, Wang Q等(2018)VI型胶原促进肺上皮细胞扩散和伤口闭合。《公共科学图书馆•综合》13(12):1。https://doi.org/10.1371/journal.pone.0209095
- 148.
Loscertales M, Nicolaou F, Jeanne M等人(2016)IV型胶原驱动肺泡上皮-内皮结合和分离的形态发生运动。BMC生物14(1):21。https://doi.org/10.1186/s12915-016-0281-2
- 149.
Whitsett JA, Kalin TV, Xu Y等(2019)通过细胞构建和再生肺细胞。杂志牧师99(1):513 - 554。https://doi.org/10.1152/physrev.00001.2018
- 150.
Mcgillick EV, Orgeig S, Morrison JL(2016)正常生长和胎盘受限胎儿气管内血管内皮生长因子对肺成熟的结构和分子调控。杂志594(5):1399 - 1420。https://doi.org/10.1113/JP271113
- 151.
王智,Chesler NC(2012)胶原含量和交联在慢性缺氧后大肺动脉硬化中的作用。机械生物模型11(1-2):279-289。https://doi.org/10.1007/s10237-011-0309-z
- 152.
Levato R, Jungst T, Scheuring RG等人(2020)从形状到功能:生物打印的下一步。阿德母亲32 (12):e1906423。https://doi.org/10.1002/adma.201906423
- 153.
Lewis KJR, Tibbitt MW, Zhao Y等(2015)利用光降解微球模板建立体外模型肺泡。Biomater Sci 3(6): 821 - 832。https://doi.org/10.1039/C5BM00034C
- 154.
Ifkovits JL, Devlin JJ, Eng G等(2009)光交联聚(癸二酸甘油)形成的具有可调性能的生物可降解纤维支架。ACS应用程序接口1(9):1878-1886。https://doi.org/10.1021/am900403k
- 155.
Chaudhuri O, Gu L, Klumpers D等人(2016)具有可调应力松弛的水凝胶可以调节干细胞的命运和活性。Nat板牙15(3):326 - 334。https://doi.org/10.1038/nmat4489
- 156.
Wolf MP, Salieb-Beugelaar GB, Hunziker P(2018)具有设计师功能-属性、修改策略和应用的PDMS。科学进展83:97-134。https://doi.org/10.1016/j.progpolymsci.2018.06.001
- 157.
Gokaltun A, Yarmush ML, Asatekin A等(2017)适用于微流控技术的非生物污染PDMS表面改性策略的最新进展。技术5(1):1 - 12。https://doi.org/10.1142/S2339547817300013
- 158.
Jeppu GP, Clement TP(2012)一种改进的Langmuir-Freundlich等温线模型用于模拟ph依赖性吸附效应。J康塔姆Hydrol 129-130:46-53。https://doi.org/10.1016/j.jconhyd.2011.12.001
- 159.
刘磊,陈杰,张伟等(2020)氧化石墨烯/聚二甲基硅氧烷复合海绵去除水中Pb(ii)的研究。RSC副词10(38):22492 - 22499。https://doi.org/10.1039/d0ra03057k
- 160.
Truskey GA(2018)用于毒理学研究的体外人体微生理系统和类器官模型。前公共治疗6:185。https://doi.org/10.3389/fpubh.2018.00185
- 161.
黄怡,何志明(2009)基于聚二甲基硅氧烷(PDMS)的微流控器件的表面分子特性修饰。微观流体纳米流体力学7(3):291 - 306。https://doi.org/10.1007/s10404-009-0443-4
- 162.
张鹏飞,张鹏飞,张鹏,等(2017)一种无涂层无污染高分子弹性体。阿德板牙29(31):1 - 8。https://doi.org/10.1002/adma.201700617
- 163.
Hung PJ, Lee PJ, Sabounchi P等(2005)用于高通量细胞分析的连续灌注微流控细胞培养阵列。Biotechnol Bioeng 89(1): 1 - 8。https://doi.org/10.1002/bit.20289
- 164.
张勇,周玲,秦玲(2014)高通量3D细胞侵袭芯片实现精确的癌症转移检测。化学学报136(4):357 - 361。https://doi.org/10.1021/ja5072114
- 165.
韩宇,段欣,杨玲等(2020)利用肺和结肠类器官鉴定SARS-CoV-2抑制剂。自然589(7841):270 - 275。https://doi.org/10.1038/s41586-020-2901-9
- 166.
谢洪林,黄建华(2019)面向器官芯片自动生成的多步流控网络。中国生物医学工程学报5(9):462 - 468。https://doi.org/10.1021/acsbiomaterials.9b00912
- 167.
Schneider G(2018)自动化药物发现。药物学报17(2):97-113。https://doi.org/10.1038/nrd.2017.232
- 168.
Gioiello A, Piccinno A, Lozza AM等人(2020)机器和自动化时代的药物化学:连续流技术的最新进展。中国生物医学工程学报63(13):6624-6647。https://doi.org/10.1021/acs.jmedchem.9b01956
- 169.
Vaishya R, Javaid M, Khan IH等(2020)人工智能(AI)在COVID-19大流行中的应用。Diabetes Metab Syndr clinical Res Rev 14(4): 337-339。https://doi.org/10.1016/j.dsx.2020.04.012
- 170.
王辉,王志伟等(2019)基于深度学习的未标记组织自身荧光图像的虚拟组织学染色。生物工程学报3(6):466-477。https://doi.org/10.1038/s41551-019-0362-y
- 171.
王斌,王斌,钱峰,等(2020)中国农业科学发展规划。AI:利用人工智能快速优化传染病干预联合疗法开发。阿德其他3(7):2000034。https://doi.org/10.1002/adtp.202000034
- 172.
李娟,傅安,张玲(2019)蛋白质-配体相互作用的分子对接评分功能综述。计算机与生命科学11(2):320-328。https://doi.org/10.1007/s12539-019-00327-w
- 173.
张磊,张辉,艾宏等(2018)机器学习方法在药物毒性预测中的应用。高等医学化学18(12):987-997。https://doi.org/10.2174/1568026618666180727152557
- 174.
Shayakhmetov R, Kuznetsov M, Zhebrak A等(2020)对抗性自编码器对期望转录组变化的分子生成。前面11:269杂志》https://doi.org/10.3389/fphar.2020.00269
- 175.
Zhavoronkov A(2020)药物化学家与机器的挑战:在药物发现方面采用和推进人工智能需要什么?化学信息模型60(6):2657-2659。https://doi.org/10.1021/acs.jcim.0c00435
- 176.
Sahu A, Qazi S, Raza K,等人(2021)COVID-19:寻找综合计算药物和再利用管道的艰难之路。载:Raza K(主编),COVID-19的计算智能方法:监测、预防、预测和诊断,pp 295-309。https://doi.org/10.1007/978-981-15-8534-0_15
确认
作者感谢美国国立卫生研究院(No. 1UG3TR003148-01)、美国心脏协会(No. 442611-NU-80922)、加州再生医学研究所(No. 1UG3TR003148-01)的资助。DISC2COVID19-11838),以及来自加州大学洛杉矶分校大卫·格芬医学院的COVID-19研究基金。作者还想感谢Jonathon Widdicombe博士回顾了早期版本的稿件,并对肺水肿和肺泡上皮细胞培养提供了深刻的讨论。图形是在生物渲染的帮助下创建的。
作者信息
从属关系
贡献
AMS、NA、SL参与概念化;原稿由AMS、TH、SL参与撰写;AMS、NA、TH、BQL、SL参与撰写、审阅、编辑。AMS和TH参与了图形的可视化。
相应的作者
道德声明
的利益冲突
AMS是Eidolon Hydros的联合创始人,这是一家专注于微生理系统和药物传递的细胞培养基质的初创公司。
伦理批准
这篇文章不包含任何作者所做的任何关于人类或动物的研究。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
孙,a.m.,霍夫曼,T.,卢,B.Q.et al。肺微生理系统在COVID-19建模和药物发现中的应用综述。Bio-des。Manuf。(2021)。https://doi.org/10.1007/s42242-021-00136-5
收到了:
接受:
发表:
关键字
- 生物工程
- 微流体
- 新型冠状病毒肺炎
- Organ-on-a-chip
- 肺
- 微血管网络
- 药物开发